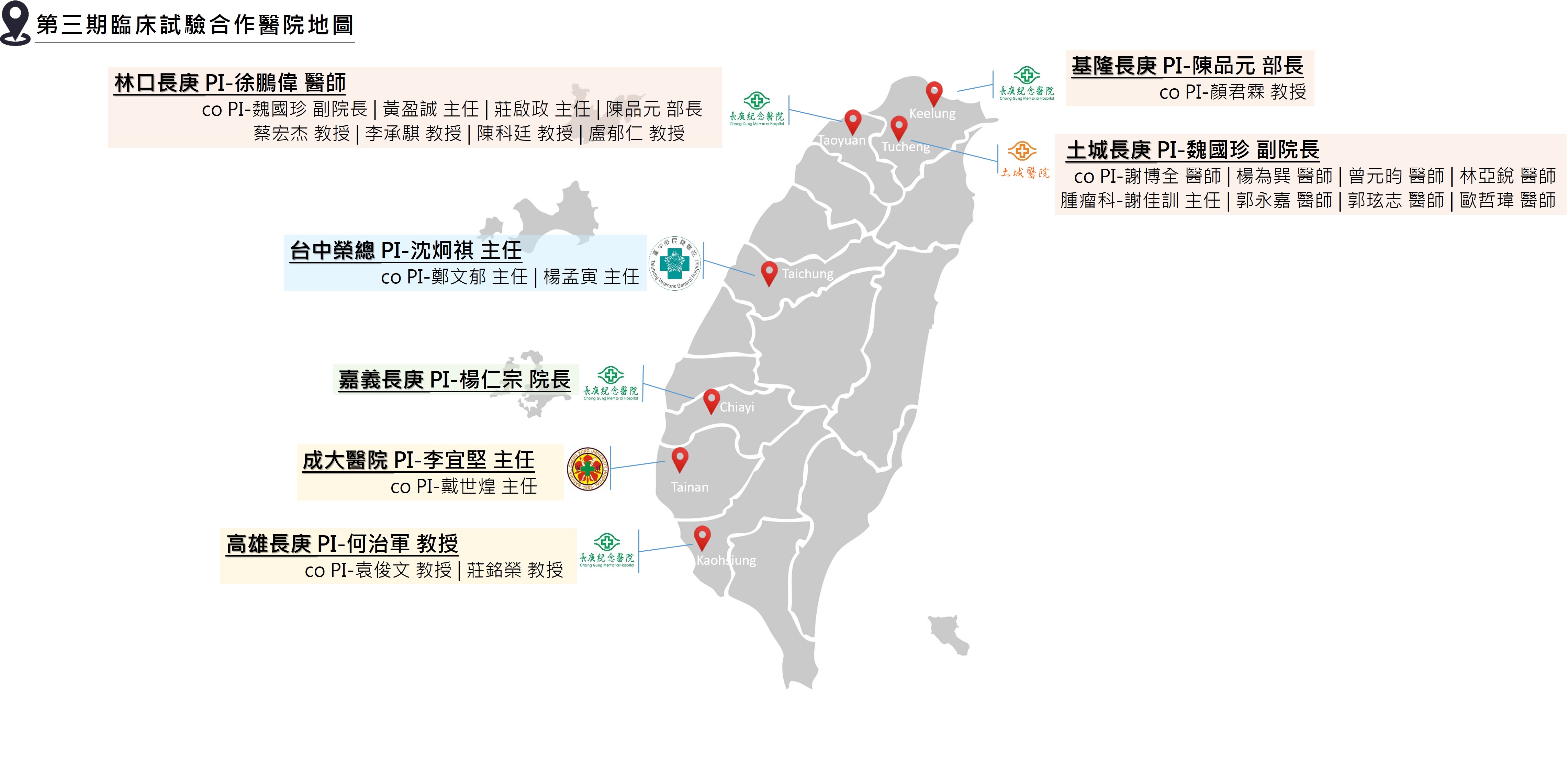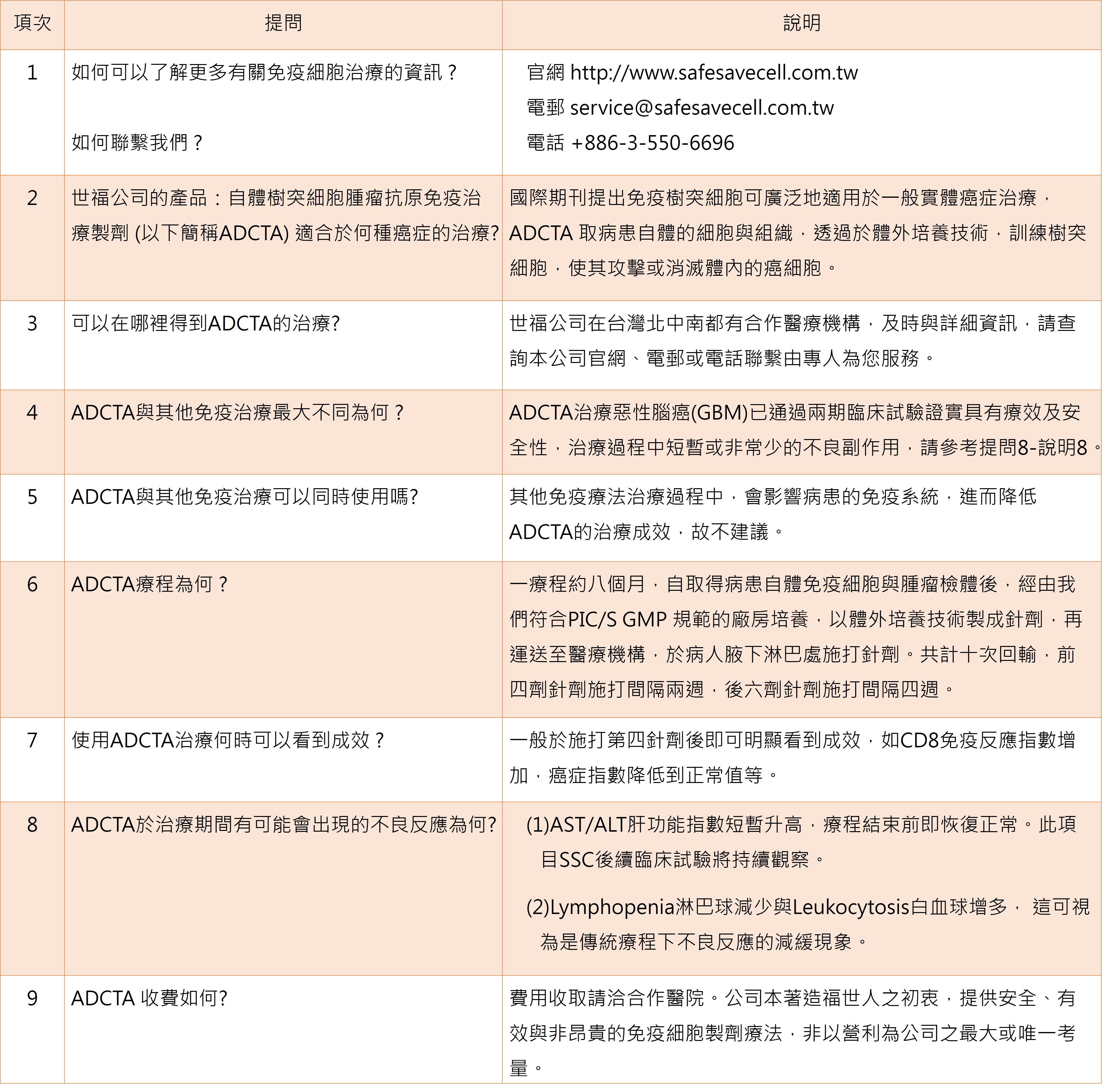


2018年9月初台灣衛生福利部發布「特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法」修正條文,開放細胞治療技術適用對象,包括自體免疫細胞治療與用於標準治療無效的癌症病人與實體癌末期病人。世福細胞已與台灣北中南多家醫院進行合作意向與計畫,為台灣的醫療技術與癌症病患服務。一直堅守扮演台灣免疫細胞治療的先鋒與領頭羊的世福細胞,冀盼經由更多治療臨床病患的成功案例,期勉成為免疫細胞治療的全球標竿。

| 醫療機構 | 項目 | 適應症 |
| 中山醫學大學附設醫院 聯絡方式: (04) 2473- 9595 |
自體免疫細胞治療-DC | 實體癌第四期: 卵巢癌、子宮頸癌、乳癌、胰臟癌、大腸直腸癌、肺癌、肺腺癌、膀胱癌、攝護腺癌、腎細胞癌、多型性膠質母細胞瘤及續發性腦癌 |
| 醫療機構 | 項目 | 適應症 |
| 奇美醫療財團法人 柳營奇美醫院 聯絡方式: (06) 622-6999 |
自體免疫細胞治療-DC | 實體癌第四期; 癌症別:多型性膠質母細胞瘤及其續發性腦癌、肺癌、乳癌、胰臟癌、結腸直腸癌、攝護腺癌、卵巢癌 |
| 醫療機構 | 項目 | 適應症 |
| 長庚醫療財團法人 林口長庚紀念醫院 |
自體免疫細胞治療-DC | 實體癌第四期:多型性膠質母細胞瘤及續發性腦癌 |
| 醫療機構 | 項目 | 適應症 |
| 奇美醫療財團法人 奇美醫院 |
自體免疫細胞治療-DC | 實體癌第四期; 癌症別:多型性膠質母細胞瘤及續發性腦癌(Brain cancer) |
| 醫療機構 | 項目 | 適應症 |
| 國立臺灣大學醫學院 附設醫院 |
自體免疫細胞治療-DC | 實體癌第四期; 癌症別:肺癌 |
| 醫療機構 | 項目 | 適應症 |
| 長安醫院 | 自體免疫細胞治療-DC | 實體癌第四期; 癌症別:多型性膠質母細胞瘤及續發性腦癌 |
| 醫療機構 | 項目 | 適應症 |
| 中山醫學大學附設醫院 聯絡方式: (04) 2473- 9595 |
自體免疫細胞治療-DC | 第一期至第三期實體癌,經標準治療無效; 癌症別:第三級神經膠質瘤、乳癌、大腸直腸癌 |
| 醫療機構 | 項目 | 適應症 |
| 義大醫療財團法人 義大癌治療醫院 |
自體免疫細胞治療-DC | 實體癌第四期; 癌症別:多型性膠質母細胞瘤及其續發性腦癌、頭頸癌、口腔癌、肺癌、胸腺癌、乳癌、胰臟癌、膽管癌、膽囊癌、腎細胞癌、大腸直腸癌、卵巢癌 |
| 醫療機構 | 項目 | 適應症 |
| 臺中榮民總醫院 | 自體免疫細胞治療-DC | 實體癌第四期; 癌症別:多型性膠質母細胞瘤及其續發性腦癌、頭頸癌、口腔癌、肺癌、胸腺癌、乳癌、胰臟癌、膽管癌、膽囊癌、腎細胞癌、大腸直腸癌、卵巢癌 |